شیمی وزندگی


 نوشته شده توسط محمدسرحدی در چهارشنبه 88/11/21 و ساعت 11:45 عصر | نظرات دیگران()
نوشته شده توسط محمدسرحدی در چهارشنبه 88/11/21 و ساعت 11:45 عصر | نظرات دیگران()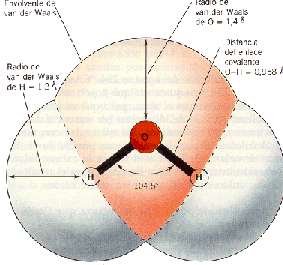
پیوند هیدروژنی نیروی ضعیفی بین اتم H و اتم الکترونگاتیو مانند N ,O ,F ازمولکول دیگر می باشد.دراین ترکیب ها اتم الگترونگاتیو جاذبه شدیدی بر الکترون های پیوندی اعمال می کند درنتیجه هیدروژن متصل به آن ها بارجزیی مثبت ( + ?)واتم الکترونگاتیو بار جزیی منفی (- ? ) قابل ملاحظه ایی کسب می نماید . کاهش ابر الکترونی روی اتم هیدروژن سبب می شود که این اتم تمایل زیادی به جذب الکترون داشته باشد .ازطرفی افزایش تراکم ابر الکترونی روی عنصر الکترونگاتیو و وجود جفت الکترون های ناپیوندی روی آن سبب می شود که این اتم تمایل به دادن الکترون ناپیوندی خود داشته باشد .
ازاین رو هنگامی که این مولکول ها در کنار یکدیگر قرار می گیرند اتم هیدروژن یک مولکول جفت الکترون ناپیوندی مولکول دیگر را به سوی خود می کشد .جاذبه ایی به وجود می آید .( انتقال الکترون ویا اشتراک الکترون صورت نمی گیرد.)که به آن نیروی هیدروژنی می گویند.ترکیب هایی که بین مولکول های آن نیروی هیدروژنی وجود دارد? نسبت به ترکیب های مشابه خود خواص غیر عادی نشان می دهند.
مولکول های آب درحالت مایع درحال حرکت نامنظم هستند . به این ترتیب که مرتبا پیوند های هیدروژنی بین آن ها درحال تغییر وتبدیل می باشد. تعداد پیوند های هیدروژنی هر مولکول آب به دما بستگی دارد . انرژی جنبشی مولکول ها با افزایش دما افزایش می یابد .هرچه دما بیشتر شود ? ازتعداد پیوند های هیدروژنی نیز کاسته می شود. فقط درحالت جامد( یخ) که انرژی جنبشی مولکول ها به حداقل خود می رسد بین مولکولها ی آب چهار پیوند هیدروژنی وجود دارد. ومولکول ها درشبکه کریستالی ثابتی و به شکل تتراهدرال قرارمی گیرند .
تشکیل کشش سطحی- بین مولکول های آب به این مولکول خواص ویژه ایی می بخشد که آن را ازمولکول های مشابه متمایز می کند. بعضی از این خواص عبارتند از
1- آب ظرفیت گرمایی بالایی دارد. به عبارتی دیگر میتواند گرمای زیادی را جذب کند یا از دست بدهد بدون اینکه درجه حرارت تغییر کند. هرچه نیروی بین مولکول های جسمی قویتر باشد جنب وجوش مولکول ها کمتر بوده وبرای افزایش دما به گرما ی بیشتری نیاز دارد.
«ظرفیت گرمایی» یک جسم ، گرمای مورد نیاز برای افزایش دمای آن به اندازه یک درجه سلسیوس است.
«کشش سطحی » مقدار گرمای لازم برای افزایش دمای یک مول از یک ماده به اندازه یک درجه سلسیوس درفشار ثابت ویا درحجم ثابت است و یکای آن -1 C ْ-1 j.mol می باشد
«ظرفیت گرمایی ویژه» گرمای مورد نیاز برای افزایش دمای یک گرم از جسمی به اندازه ی یک درجه سلسیوس است.یکای ظرفیت گرمایی j . C-1 . g -1 و یا j g-? . K-? است.
( ?t تغییر دما × m جرم جسم ) / q مقدار گرمای مبادله شده = C ظرفیت گرمایی ویژه
2- آب گرمای نهان بالایی دارد. گرمای نهان? انرژیی است که مقدار معینی ( یک گرم ویا یک مول ) از جسم می گیرد . و بدون تغییر دما از حالتی به حالت دیگرتبدیل می شود .
3-آب در حالت جامد کم چگالتر از مایع میباشد، به علت تشکیل حفره های توخالی در شبکه کریستالی یخ ? حجم درحالت جامد افزایش می یابد . به همین علت یخ سبکتر از آب درحالت مایع است .
4- آب یک حلال مناسب نه تنها برای ترکیب های قطبی و یونی می باشد. بلکه بعضی مواد را به کمک پیوند هیدروژنی درخود حل می نماید .همچنین گازهایی نظیر اکسیژن و دی اکسید کربن نیزدرحفره های به وجودآمده درنتیجه پیوند هیدروژنی به دام می اندازد. ودرنتیجه اثر القایی درخود نگه می دارد .یکی از عللی که در دماهای پایین تر میزان انحلال گاز ها در آب افزایش می یابد.? همین علت است.
5- آب دارای کشش سطحی است. نیروی هیدروژنی بین مولکول های آب درسطح مایع مانند یک پوسته نازک عمل می نمایند به طوری که این اجازه رابه آب می دهند که بتواند اجسام نازک مانند یک تیغ ریش تراشی ویاگرد موادی نظیر کربن ویا یک پشه را علیرغم جرم حجمی بیشتر درسطح خودنگه دارند.
6- آب ویسکوزیته یا غلظت دارد. مقاومت بین لایهها ی مایع را ویسکوزیته (گرانروی ) یا غلظت نامیده میشود .
آب خالص خنثی و PH آن برابر باهفت است . مولکول های آب به مقدار جزیی یونش می یابند ( تقریبا ازهر 555 میلیون مولکول دوعدد ودریک زمان بسیار کوتاه ) . اما از آنجا که تعداد مول هایعنی غلظت + OH - , H باهم برابر است . آب خالص خنثی خواهد ماند. لازم بتذکر است که یون + H به دلیل کوچکی بیش از حدو تراکم زیاد بار الکتریکی درآن جاذبه شدیدی برجفت الکترون ناپیوندی مولکول آب وارد می کند و در محلول آبی آبپوشیده می شود وبهمین علت حداقل بایک مولکول آب دیگر پیوندداده وبه صورت یون + H3O درمی آید .
معادله تفکیک یونی آب را غالبا به صورت زیر نشان می دهند .
( H2O ( l ) + H2O ( l ) <=====> H3O+ ( aq ) + OH - (aq
14- 10 ×1 = [- KW = [H3O+].[OH
شواهد نشان می دهد . که بابیش از یک مولکول آب می تواند پیوند هیدروژنی برقرار نموده و یون های +H5O2 و +H7O3 و +H9O4 را تشکیل دهد.

باکلیک در اینجافلش زیبایی درمورد آب خواهید دید که اطلاعات خوبی درباره چگونگی تشکیل آب نحوه نمایش این مولکول و پیوند هیدروژنی و محاسبه PH ...... به شما می دهد .امیدوارم خوشتون بیاد
 نوشته شده توسط محمدسرحدی در چهارشنبه 88/11/21 و ساعت 11:40 عصر | نظرات دیگران()
نوشته شده توسط محمدسرحدی در چهارشنبه 88/11/21 و ساعت 11:40 عصر | نظرات دیگران()نیاز است.( طبق تعریف مقدار انرژی اتم منفی است)

3- اثر الکترون اضافی : الکترون دوم انرژی اوربیتال را? افزایش می دهد به مثال زیر توجه نمایید.
انرژی اوربیتال H= -1311kj mol-1 1s
انرژی اوربیتال He = -2372 kj mol-1 1s
انرژی اوربیتال He += -5250 kj mol-1 1s4- اثر شکل اوربیتال : قدرت نفوذ الکترون در اوربیتال s > p > d > f می باشد . اوربیتال s بعلت شکل کروی که
دارد تا نزدیکی هسته می تواند نفوذ کند ودرنتیجه جاذبه هسته برروی

عناصر است.

 نوشته شده توسط محمدسرحدی در چهارشنبه 88/11/21 و ساعت 11:36 عصر | نظرات دیگران()
نوشته شده توسط محمدسرحدی در چهارشنبه 88/11/21 و ساعت 11:36 عصر | نظرات دیگران()