شیمی وزندگی

هر یک از جملههایی که در پی می آید، اشارهای به یکی از عنوانهای درسی شیمی است. اگر بتوان برای هر نکته، جملهی مانند این نمونهها فراهم کرد، مفاهیم درسی به شکلی ماندگارتر در ذهن دانشآموزان باقی می ماند و اثر چشمگیرتری بر آنها و زندگیشان خواهد داشت.
? جنس زغال و الماس هر دو از کربن است. این، به رفتار اتمهای کربن بستگی دارد که به زغال تبدیل شوند یا الماس شوند. زمانی که می توان الماس بود، چرا زغال باشیم؟
? فلوئور با ارادهترین عنصر است. او حتی آرگون تنبل را به انجام واکنش وادار می کند. (اشاره به مولکول ArF4 و ArF6).
? فلوئور، در دوستی سنگ تمام می گذارد. اگر با عنصری دست رفاقت بدهد، هیچ چیز نمی تواند او را از رفیقش جدا کند. او با همهی علاقهی که به حفظ الکترونهایش دارد، هنگامی که کمبود بور را نسبت به الکترود می بیند، او را در الکترونهای خود سهیم میکند (BF3).
? هر چه اتمها بزرگتر می شوند (شعاع اتمی که بیشتر می شود)، از داراییهای خود (یعنی الکترونها) راحتتر می گذرند. برخلاف انسانها که هر چه مسنتر می شوند به آن چه دارند، وابستگی بیشتر پیدا می کنند و بخشش کمتری از خود نشان می دهند.
? آب با همهی لطافت و نرمی که دارد، سرسختترین مواد به شمار می رود. اگر دستش به بلور نمک برسد، شبکهی سخت آن را چنان درهم می شکند که با وجود همهی آن نیروی جاذبهی قوی که میان یونها وجود دارد، هر یک به سویی می گریزند و به محاصره مولکولهای آب درمی آیند؛ کاری که از هیچ پتک یا چکشی برنمی آید.
? همیشه نباید بری رسیدن به کمال، چیزی را به دست آورد. گاه گذشتن از چیزهایی که داریم، راه کمال را پیش روی ما می گشاید. درست مانند سدیم که تا از آخرین الکترون لایهی ظرفیتش نگذرد به آرایش الکترونی کامل دست نمی یابد.
? هر چه اندازهی مولکول در هیدروکربنها بیشتر می شود بهتر و قویتر یکدیگر را جذب می کنند و به هم نزدیکتر می شوند. اما چرا برخی از انسانها هر چه بزرگتر می شوند، بیشتر از هم فاصله می گیرند؟
? چه صبری دارد این آب! دیر جوش می آورد و زیر فشار دیرتر از کوره در می رود.
? اکسیژن رفیق نابابی است. همنشینی با او سرانجامی جز خاکستر و دود شدن در هوا ندارد.
? بیچاره منیزیم وقتی به اکسیژن می رسد، چشمانش چه برقی می زند! بی آنکه بداند اکسیژن چه خوابی برایش دیده است، با شوق به استقبال دشمن جانش می رود.
? هنگامی که مواد وارد جمع می شوند (مخلوط تشکیل می دهند)، اصالت خود را حفظ می کنند. برخلاف برخی از آدمها که با ورود به هر محیط تازه، به رنگ جمع درمی آیند.
? گرمای تشکیل ترکیبها منفی است. یعنی عنصرها «با هم بودن» را بیشتر دوست دارند. پس چرا برخی از ما بر طبل جدایی می کوبیم؟
? عشق را باید از سدیم آموخت که وقتی به آب می رسد از شوق رسیدن به دوست، ذوب می شود و همهی هستی را فدای یار می کند، چنان که دیگر اثری از او بر جای نمی ماند. تنها یک قطره فنول فتالیین کافی است تا خونی را که نثار کرده است، نشان دهد.
? زباله را ببینید، حتی زباله هم بکار می آید. بری همین نام «طلای کثیف» به آن دادهاند. چه قدر بد است که از ما کاری برنیاید.
? اگر به واکنشی که در حال تعادل است، تغییری تحمیل شود، واکنش با این تغییر مبارزه می کند تا اثر آن را تا جای ممکن تعدیل کند. افسوس که برخی از ما خیلی زود تسلیم محیط اطراف خود می شویم.
? طلا و پلاتین فلزهایی ثابت قدم هستند. چون در برابر شرایط مناسبی که وجودشان را به خطر می اندازد، پایداری نشان می دهند و تلاش می کنند که اصالت خود را هم چنان حفظ کنند.
? پیوند I-I از پیوندهای Br-Br و Cl-Cl سستتر است. جای تأسف است که مولکولهای دو اتمی این هالوژنها، هر چه بزرگتر می شوند، ارتباطشان ضعیفتر و پیوندشان سستتر می شود.
? می دانید چرا پیوند F–F با ین که از Cl-Cl کوتاهتر است، سستتر است؟ اتمهای فلوئور در دوستی با یکدیگر حدی را رعیت نمی کنند. خودمانی شدن زیاد هم می تواند مشکلاز باشد.
? برخی عنصرها مانند لیتیم و بریلیم، که کوچکترین عضو خانوادهی خود هستند، گویی تافتهی جدا بافتهاند! آنها در برابر قوانین خانوادگی نافرمانی نشان می دهند. جالب است که افراد دیگر خانواده هم در برابر سرپیچی آنها سکوت کردهاند.
? کنترل خانوادهی پرجمعیت کار دشواری است. اتم کربن، خانوادهی کم جمعیت خود را خوب اداره می کند و هوای الکترونهایش را دارد. اما سرب که هم گروه با کربن است، در برابر برخی عنصرهای سودجو، از نگهداری الکترونهیش ناتوان است و دو یا چهار الکترون از دست می دهد.
? سوختن آلکانها، فرایندی برگشتناپذیر است. راستی چرا ین ترکیبها بدون توجه به سرانجامی که در انتظارشان است، به سرعت و بدون هیچ پایداری، گام در راه نابود کردن خود می گذارند؟
? هنگامی که الکتونها سوار اتوبوس زیرلایه می شوند، نخست هر یک از آنها یک صندلی دوتایی را بری نشستن انتخاب می کنند. الکترونهایی که دیرتر می رسند، اگر صندلی دوتایی خالی پیدا نکنند، کنار الکترونهای نشسته می نشینند. ما هم همین کار را می کنیم، مگر نه؟
? در رسم ساختار لوویس، پدر خانواده (اتم مرکزی در مولکول) نخست الکترونها را میان فرزندان خانواده (مولکول) تقسیم می کند. هنگامی که پدر با کمبود الکترون روبرو می شود، فرزندان پدر را در الکترونهای خود شریک می کنند.
? آب، واقعاً مادهی شگفتانگیز است. اگر آب نبود هیچ بندهی پشیمانی بر گذشتهی بد خود نمی گریست، مروارید اشک بر گونهی هیچ بندهی سحرخیزی نمی غلتید، بر پیشانی هیچ گناهکاری عرق شرم نمی نشست، هنگامی که پس از سالها دوری، به عزیزی می رسیدیم، نمی توانستیم اشک شوق بریزیم و اگر کار نادرستی از ما سر می زد، نمی دانستیم از خجالت، چه بشویم ...
 نوشته شده توسط محمدسرحدی در پنج شنبه 89/9/11 و ساعت 11:39 عصر | نظرات دیگران()
نوشته شده توسط محمدسرحدی در پنج شنبه 89/9/11 و ساعت 11:39 عصر | نظرات دیگران()میلیونها ماده مرکب شناخته شده فقط از غیر فلزات ترکیب یافتهاند. این مواد مرکب فقط شامل عناصری هستند که در هر اتم 4 ، 5 ، 6 یا 7 الکترون والانس دارند. بنابراین الکترونهای والانس اتمهای غیر فلزی ، آنقدر زیاد است که اتمها نمیتوانند با از دست دادن آنها ساختار یک گاز نجیب را به دست آورند. معمولا غیر فلزات با جفت کردن الکترونها پیوند ایجاد میکنند و در این فرآیند به ساختار یک گاز نجیب میرسند.
استحکام پیوند کووالانسی
آنچه اتمهای یک ملکول را به هم نگه میدارد، پیوند کووالانسی است، در تشکیل پیوند کووالانسی الکترونها ، به جای آنکه از اتمی به اتم دیگر منتقل شوند، میان دو اتم به اشتراک گذاشته میشوند. استحکام پیوند کووالانسی ناشی از جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. یا به عبارت دیگر مربوط به آن است که هر دو هسته الکترونهای مشترکی را جذب میکنند.
نحوه تشکیل اوربیتال مولکولی
دو اوربیتال به نحوی همپوشانی میکنند که ابرهای الکترونی ، در ناحیه بین دو هسته ، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد طبق اصل طرد پاولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. در نتیجه تشکیل پیوند اوربیتالهای اتمی به اوربیتال مولکولی تبدیل میشود.
انواع پیوند کووالانسی
پیوند یگانه کووالانسی
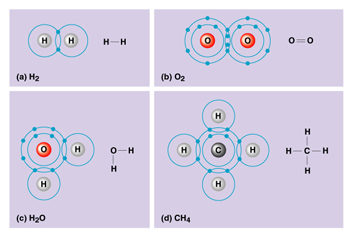
متشکل از یک جفت الکترون (دارای اسپین مخالف) است که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند. سادهترین نمونه اشتراک در مولکولهای دو اتمی گازهایی از قبیل F2 ، H2 و Cl2 دیده میشود. اتم هیدروژن فقط یک الکترون دارد هرگاه دو اتم هیدروژن تک الکترونهای خود را به اشتراک بگذارند، یک جفت الکترون حاصل میشود.
این جفت الکترون پیوندی متعلق به کل مولکول هیدروژن است و به آرایش الکترونی پایدار گاز نجیب هلیم میرسد. هر الکترون هالوژن ، هفت الکترون والانس دارد. با تشکیل یک پیوند کووالانسی بین دو تا از این اتمها ، هر اتم به آرایش الکترونی هشت تایی ، که ویژه گازهای نجیب است، میرسد.
پیوند چند گانه
بین دو اتم ، ممکن است بیش از یک پیوند کووالانسی تشکیل شود در این موارد گفته میشود که اتمها با پیوند چند گانه به هم متصلاند. دو جفت الکترون مشترک را پیوند دو گانه و سه جفت الکترون مشترک را پیوند سه گانه مینامند. اغلب میتوان تعداد پیوندهای جفت الکترونی را که یک اتم در یک مولکول بوجود میآورد از تعداد الکترونهای مورد نیاز برای پر شدن پوسته والانس آن اتم ، پیشبینی کرد.
چون برای فلزات شماره گروه در جدول با تعداد الکترونهای والانس برابر است، میتوان پیش بینی کرد که عناصر گروه VIIA مثل Cl (با هفت الکترون والانس) ، برای رسیدن به هشت تای پایدار ، یک پیوند کووالانسی ، عناصر گروه VIA مثل O و S (با شش الکترون والانس) دو پیوند کووالانسی ، عناصر VA مثل N و P (با پنج الکترون والانس) سه پیوند کووالانسی و عناصر گروه IVA مثل C (با چهار الکترون والانس) چهار پیوند کووالانسی به وجود خواهند آورد.
نماد ساختار مولکول
در ساختار اول ، جفت الکترون مشترک با دو نقطه و ساختار دوم با یک خط کوتاه نشان داده شده است.
مانند :
 نوشته شده توسط محمدسرحدی در پنج شنبه 89/9/11 و ساعت 11:29 عصر | نظرات دیگران()
نوشته شده توسط محمدسرحدی در پنج شنبه 89/9/11 و ساعت 11:29 عصر | نظرات دیگران()ساختار لوویس
ساختار لوویس نوعی فرمول ساختاری است که ترتیب وصل شدن اتم ها، جفت الکترون های پیوندی و الکترون های ناپیوندی را نشان می دهد.در این ساختار جفت الکترون های ناپیوندی به وسیله نقطه هایی به صورت (:) و جفت الکترون های پیوندی نیز به وسیله (..) یا به صورت خط تیره (-) نمایش داده می شود.
در ترکیب هایی که در آن همه اتم ها (البته به جز H) به آرایش هشت تایی رسیده اند و هر اتم H دو الکترونی می باشد می توان با استفاده از قواعد زیر ساختار لوویس ترکیبهای مولکولی ساده را به دست آورد:
1- با توجه به فرمول مولکولی ترکیب ارائه شده مجموع الکترونهای مربوط به تراز ظرفیت اتم ها را حساب می کنیم.
نکته: اگر ترکیب دارای بار باشد به ازای هر بار منفی یک الکترون اضافه و به ازای هر بار مثبت یک الکترون کم می کنیم.
2- نماد اتمها را به ترتیب صحیح در جای خود چیده و با قرار دادن جفت الکترونهای پیوندی و ناپیوندی همه اتمها به جز H را به آرایش هشت تایی می رسانیم.
3- تعداد الکترونهای چیده شده را با مجموع تعداد الکترونهای تراز ظرفیت اتمها مقایسه می کنیم تا درستی ساختار تأیید شود.
4- هر جفت الکترون پیوندی را با خط تیره (-) جایگزین می کنیم.
5- اطمینان حاصل می کنیم که تمام اتمها به جز H از قاعده هشت تایی تبعیت می کنند.
باید دقت داشته باشید که:
1- در ترکیب های چند اتمی ساده اتم مرکزی معمولاً عنصری است که یک اتم از آن در ترکیب مورد نظر وجود دارد و اگر در مورد دو عنصر این شرط برقرار باشد معمولاً اتم دارای الکترونگاتیوی کمتر اتم مرکزی در نظر گرفته می شود.
2- اتم های F, H تنها با یک اتم پیوند برقرار می کنند و فقط در بخش انتهایی یا بیرونی ترکیب قرار می گیرند.
3- سایر هالوژنها (I, Br, Cl) نیز در صورتی که اتم مرکزی نباشند با برقراری تنها یک پیوند در بخش انتهایی یا بیرونی ترکیب قرار می گیرند. البته این اتمها ممکن است نقش اتم مرکزی را داشته باشند. در این صورت بدیهی است که بیش از یک پیوند خواهند داشت.
4- در مورد ترکیبهایی که دارای بار می باشند کل ساختار رسم شده درون کروشه قرار می گیرد و بار ترکیب در گوشه بالا و سمت راست کروشه قرار داده می شود.
قلمرو الکترونی
قلمرو الکترونی ناحیه ای اطراف اتم مرکزی است که الکترونها صرف نظر از تعدادشان می توانند در آن قرار گیرند. در این تعریف پیوندهای یگانه، دو گانه و سه گانه و نیز هر زوج غیر پیوندی یک قلمرو محسوب می شوند.
نکته: در رسم ساختار لوویس باید دقت کرد که هنگامی که گونه مورد بررسی دارای بار منفی است الکترون اضافی مربوط به اتمی است که الکترونگاتیوی بیشتری دارد در هنگامی که گونه مورد بررسی دارای بار مثبت است الکترون از اتمی جدا می شود که الکترونگاتیوی کمتری دارد.
 نوشته شده توسط محمدسرحدی در پنج شنبه 89/9/11 و ساعت 11:25 عصر | نظرات دیگران()
نوشته شده توسط محمدسرحدی در پنج شنبه 89/9/11 و ساعت 11:25 عصر | نظرات دیگران()سوالات امتحان نهایی شیمی دوازدهم
شیمی(3) و آزمایشگاه شهریور96
شیمی(3) و آزمایشگاه خرداد96
شیمی 3وازمایشگاه دی 95
شیمی(3) و آزمایشگاه شهریور 95
شیمی (3 ) وآزمایشگاه خرداد95
شیمی (3) و آزمایشگاه دی ماه 94
تکمیل شدن سطر هفتم جدول تناوبی عناصر (جدول مندلیف)
شیمی (3) و آزمایشگاه
شیمی 3 خرداد94 با کلید سوالات
شیمی (3)و آزمایشگاه دی ماه 1393 .اخرین امتحان در سال 93
شیمی (3) و آزمایشگاه شهریور 93
شیمی (3) و آزمایشگاه خرداد93
چرا شعاع اتمی گالیم از آلومینیوم کم تر است؟
[همه عناوین(173)][عناوین آرشیوشده]
بازدید دیروز: 108
مجموع بازدیدها: 1120815
14-سایت پزشکی دکترسخنی
وبلاگ گروهیِ تَیسیر
25-وبلاگ ترنم
21-وبلاگ زیبای غزلک
.12شیمی شاهد(طاهری)
خوب نگاه کن
شیمی تحصیلی
20-20باغ بهاری
11گروه شیمی قائمشهر
شیمی و زندگی
2-میعادگاه کیمیاگران جوان
4-تصاویر اوربیتال های اتمی و ویژگ&
5-جستجو گر مولکول های شیمیایی
6-آیوپاک
7-سوال وجواب شیمی
خطاطی انلاین
سایت آموزشی قران کریم آنلاین
قربونت برم خ د ا
شیمی +زندگی(راحین)